Calor
Você já passou por situações, por exemplo, um almoço, em um dia quente de verão, em que você retirou uma jarra de suco da geladeira, deixou sobre a mesa e depois de um tempo percebeu que o suco “esquentou”, isto é, sua temperatura aumentou em relação a temperatura de quando o suco foi retirado da geladeira. No mesmo almoço você percebe que a panela que continha comida “quente retirada do forno, depois de um tempo “esfria”, isto é, sua temperatura diminui.
COLOCAR FIGURA
Mas por que isso acontece? Por que os corpos mudam de temperatura?
A resposta para essa pergunta é a troca de energia entre os corpos e o ambiente devido a diferença de temperatura. Essa energia é chamada de energia interna ou térmica, que é a soma das energias cinética, associadas ao movimento aleatório dos átomos, moléculas ou outros corpos minúsculos que fazem parte do objeto, e energia potencial.
A energia térmica transferida é chamada de calor ![]() . Como o corpo pode absorver ou ceder calor, dizemos por convenção, que quando o corpo absorve calor, essa quantidade de energia é positiva
. Como o corpo pode absorver ou ceder calor, dizemos por convenção, que quando o corpo absorve calor, essa quantidade de energia é positiva ![]() e quando cede calor, a quantidade de energia é negativa
e quando cede calor, a quantidade de energia é negativa ![]() .
.

Com a transferência de calor a temperatura de A vai diminuindo devido a perda de energia e a temperatura de B vai aumentando pelo fato de estar absorvendo energia. Em um determinado momento as temperaturas serão iguais e a troca de calor entre os corpo cessará e dizemos que o sistema entrou em equilíbrio térmico.
Assim podemos voltar a nossa questão do início da discussão: Por que o suco esquentou e a comida esfriou?
A resposta é que como o suco estava a uma temperatura menor que o ambiente (cozinha ou sala de jantar) ele absorveu calor do ambiente ficando com a mesma temperatura do ambiente. Em relação à comida, esta cedeu calor para o ambiente, pois estava com uma temperatura maior. Portanto podemos dizer que o suco e a comida entraram em equilíbrio térmico com o ambiente.
Uma outra forma de transferir calor é por meio de trabalho ![]() que associamos até agora a aplicação de uma força sobre um sistema que provoca deslocamento no mesmo.
que associamos até agora a aplicação de uma força sobre um sistema que provoca deslocamento no mesmo.
O calor e trabalho tem significado apenas enquanto ocorre transferência de energia para um sistema, somando -se ou subtraindo -se energia interna total.
Observando o Calor e Trabalho
Para entendermos melhor como o calor e trabalho são trocados com o ambiente vamos considerar como sistema um gás.
Imagine que este gás confinado em um recipiente cilíndrico totalmente isolante, que não permite a troca de calor com o meio externo. O cilindro apresenta-se em um estado inicial em que ocupa um volume ![]() , está submetido a uma pressão inicial
, está submetido a uma pressão inicial ![]() e apresenta uma temperatura
e apresenta uma temperatura ![]() . Para mudar essas condições para um estado final em que apresenta
. Para mudar essas condições para um estado final em que apresenta ![]() ,
, ![]() e
e ![]() é preciso que o sistema passe por um processo termodinâmico, que está caracterizado pelo fato das grandezas
é preciso que o sistema passe por um processo termodinâmico, que está caracterizado pelo fato das grandezas ![]() ,
, ![]() e
e ![]() variarem obedecendo a Lei geral dos gases.
variarem obedecendo a Lei geral dos gases.
Vídeo 4: Lei geral dos gases ideias
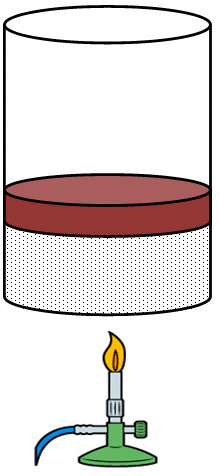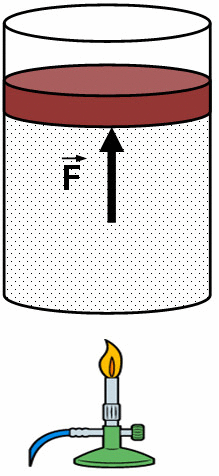
O calor transferido ou retirado do sistema pode fazer com que o êmbolo suba 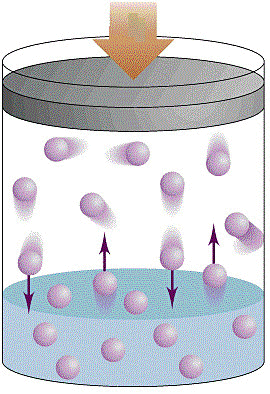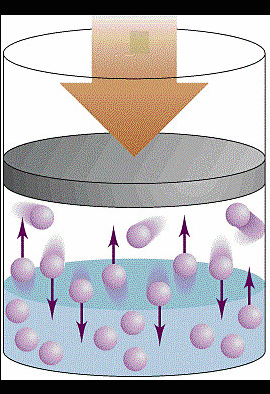 ou desça. Se o êmbolo subir significa que o gás no interior do cilindro, aplicou uma força sobre o êmbolo e faz com que o mesmo se desloque e neste caso dizemos que o gás realizou trabalho e parte da energia. Agora se o êmbolo descer significa que um agente externo aplicou uma força sobre o êmbolo e dizemos que o gás recebeu trabalho.
ou desça. Se o êmbolo subir significa que o gás no interior do cilindro, aplicou uma força sobre o êmbolo e faz com que o mesmo se desloque e neste caso dizemos que o gás realizou trabalho e parte da energia. Agora se o êmbolo descer significa que um agente externo aplicou uma força sobre o êmbolo e dizemos que o gás recebeu trabalho.
A afirmação acima nos leva novamente à página Trabalho e Energia cinética em que foi abordado o conceito de trabalho, onde vimos que se uma força aplicada sobre um sistema é capaz de mover o mesmo, dizemos que essa força aplicada pelo outro sistema realizou trabalho. Assim vamos determinar o volume realizado ou recebido pelo gás.
Vamos imaginar que um gás exerce uma força ![]() sobre o êmbolo que possui uma área
sobre o êmbolo que possui uma área ![]() . Quando o gás exerce força sobre a área temos a pressão e podemos escrever a força como:
. Quando o gás exerce força sobre a área temos a pressão e podemos escrever a força como:
![]()
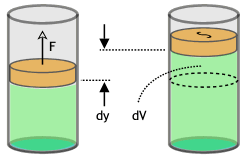 Pensando em um processo lento, podemos considerar que a força é constante e que o deslocamento do êmbolo é muito pequeno determinamos o trabalho realizado realizado pelo gás, pois
Pensando em um processo lento, podemos considerar que a força é constante e que o deslocamento do êmbolo é muito pequeno determinamos o trabalho realizado realizado pelo gás, pois ![]() representa o deslocamento do êmbolo e
representa o deslocamento do êmbolo e ![]() representa a variação de volume e podemos escrever que
representa a variação de volume e podemos escrever que ![]() . Pensando em um diagrama em que a pressão varia com o volume temos o trabalho é numericamente igual a área.
. Pensando em um diagrama em que a pressão varia com o volume temos o trabalho é numericamente igual a área.
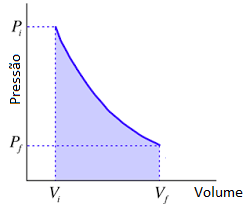
Então podemos calcular o trabalho como:
![]()
Realizando a integral encontramos o trabalho total realizado pelo gás
![]()
O resultado do trabalho depende de como a pressão varia em função do volume para o qual o sistemas muda de um estado inicial para um estado final, isto é, qual o tipo de transformação gasosa o gás sofre, isotérmica, isobárica, isocórica ou adiabática.
Vídeo 5: Transformações gasosas
Se o sistema absorve calor de um fonte térmica, sua energia interna irá aumentar fazendo com que o gás realize trabalho para manter e se o sistema perder calor, sua energia interna irá diminuir permitindo com que o sistema receba trabalho.
Até o momento já vimos que um sistema representado por um gás é capaz de receber ou realizar trabalho. Mas de onde vem essa força dos gases capaz de mover o êmbolo?
Podemos dar a resposta pensando na definição de trabalho que é a transferência de energia por meio de uma força ou várias forças que agem sobre um corpo. Mas então resta outra pergunta: De onde vem essa energia?
A resposta é a energia interna. A energia interna de um gás é determinada pela soma das energias cinéticas de agitação , potencial de agregação, de ligação e nuclear entre as partículas. Assim quando um sistema realiza trabalho podemos dizer ocorre variação de sua energia interna.
Na seção Energia potencial vimos que a energia transferida pelo trabalho é armazenada na forma de energia potencial. Esta energia é o negativo do trabalho é a variação da energia potencial ![]() . Voltando para o sistema termodinâmico (gás) temos que a energia transferida pelo trabalho é armazenada na forma de energia interna
. Voltando para o sistema termodinâmico (gás) temos que a energia transferida pelo trabalho é armazenada na forma de energia interna ![]() .
.
O texto PotenciaisTermodinâmicos apresenta uma explicação de nível superior sobre a relação entre energia interna e potencial, baseada conceito entropia e outras variáveis como temperatura, volume e número de mols de um gás.
Ir para a próxima página: Primeira Lei da Termodinâmica